Leseprobe

Abkürzungs- & Definitionsverzeichnis III
Abkürzungs- & Definitionsverzeichnis

- Verteilung (Wilfredo Pareto, Italien, 1848-1923), mit 20 % der Kunden
werden 80 % des Umsatzes gemacht = A-Kunden. Sinngemäß gilt dies
für B, C. Betriebswirtschaftliches Standardinstrument.
Abkürzungs- & Definitionsverzeichnis III

Kodifizierung der generellen Regeln und Maßnahmen veröffentlicht im
Federal Register und Federal Government (USA). Aufgeteilt in 50 Titel,
wird jährlich aktualisiert. Offizielles FDA Regelwerk bestehend aus
einzelnen Teilen („Part“). Vgl. 21 CFR Part 11, 21 CFR Part 820. Persönlichkeit, Summe aller Charakteristika des Unternehmens.
Besteht aus Corporate Design (CD), Corporate Communication (CC),
Corporate Image (CIg) und Corporate Behaviour (CB). Mit der Hilfe eines Datenbankmanagementsystems (DBMS) müssen
Daten so lange aufbewahrt werden, bis sie explizit gelöscht werden.
Die Lebensdauer ist somit nur vom Benutzer direkt abhängig und nicht
von Systemgegebenheiten oder anderen Unwägbarkeiten. Nationale Normungsorganisation, Berlin, privatwirtschaftlich eingetragener Verein (nationales Normungsinstitut der Bundesrepublik). Dokument Technologien dienen zur Erzeugung, Erfassung,
Erschließung, Verwaltung, Aufbereitung, Bereitstellung, Verteilung,
Sicherung und Bewahrung von elektronischen Dokumenten. EDI: Elektronischer Datenaustausch, Alle elektronischen Verfahren
zum asynchronen und vollautomatischen Versand von strukturierten
Nachrichten zwischen Anwendungssysteme unterschiedlicher
Institutionen.
EDIFACT: konkrete Ausprägung, Standard der UN. Engl.: Fehlermöglichkeits- und Auswirkungsanalyse, oft als Fehlermöglichkeits und Einflussanalyse beschrieben, analytische Methode
um potentielle Schwachstellen zu finden, Erwähnt: United States
Military Procedure, MIL-P-1629 am 09.11.1949. USA Behörde, dem Gesundheitsministerium unterstellt. Ziel ist der
Schutz der öffentlichen Gesundheit in den USA. Kontrolliert die
Sicherheit & Wirksamkeit von Human- und Tiermedizin, biologischen
Produkten, Medizinprodukten, Lebensmitteln und Strahlenemittieren- Geräten für in den USA hergestellte und importierte Produkte. Gute Herstellungspraxis, Richtlinien zur Qualitätssicherung der
Produktionsabläufe und -umgebung in der Produktion von Arznei- Wirkstoffen und Medizinprodukten. „Current“ bezieht sich auf
die aktuell gültige Version.
Internationale Organisation für Normung (Vereinigung aller
internationalen Normungsinstitute), Genf.
Nachweis von Substanzen in Körperflüssigkeiten wie Blut, Blutserum,
Blutplasma, aber auch Urin, Speichel, Exkrementen oder Atem. Im
Gegensatz zu „in vivo“ (im Körper, am lebenden Objekt) erfolgen hier
die diagnostischen Nachweise außerhalb des Körpers. Veränderung zum Besseren von Taiichi Ohno (Jap.) Managementkonzept (Toyota ca. 1950), Grundlage von vielen „Neuen“ Konzepten. Methode der Produktionsablaufsteuerung mit Kärtchen, 1947 Toyota
Motor Corporation (Jap.: Original: Kamban) Hol- bzw. Zurufprinzip.
Abkürzungs- & Definitionsverzeichnis III

DIN EN ISO 14971:2000, DIN EN ISO 13485:2003 alle einzeln oder
miteinander verbundene Apparate, Instrumente, Vorrichtungen, Stoffe
oder Gegenstände, einschließlich der für ein einwandfreies Funk- eingesetzten Software die vom Hersteller zur Anwendung für
Menschen bestimmt ist.
Beschreibt die automatische Texterkennung von (meist eingescannten)
gedruckten Vorlagen z.B. FAX zur Umwandlung in EDV -
weiterverarbeitbare Daten.
Engl.: Zusatzmodul, Ergänzungsmodul, Bezeichnung für ein Computerprogramm das in ein anderes Softwareprodukt eingeklinkt ist um
zusätzliche Funktionen anzubieten, Kein Update. Plattformübergreifendes Dateiformat für druckbare Dokumente von
ADOBE ® Systems, A = Archivierung, Langzeitarchivierung und
Barrierefreiheit. Erreicht durch ein standardisiertes Format, dass z.B.
alle Fremdabhängigkeiten & Referenzen nicht zulässt, zudem sind alle
Schriften automatisch eingebunden (ISO 19005-1:2005). Produktlebenszyklusmanagement, alle Daten, die bei der Entstehung,
Lagerhaltung und Vertrieb eines Produktes anfallen sind einheitlich
gespeichert, verwaltet und können abgerufen werden. DIN EN ISO 9000:2000, DIN EN ISO 14971:2000 mehrere in Wechselbeziehung oder Wechselwirkung stehende Tätigkeiten, wandelt
Eingaben in Ergebnisse um.
DIN EN ISO 9000:2000 die Qualität ist der Grad, in dem mehrere
inhärente Merkmale Anforderungen erfüllen. „Inhärent“ bedeutet „einer
Einheit innewohnend“, insbesondere als ständiges Merkmal. Tools zur Administration u.a. von Arbeitsplatzrechnern (MICRO-SOFT ® ). Nicht vergleichbar mit Short Messaging Service (SMS), dem
Dienst der Kurznachrichten auf Mobilfunkempfänger versendet. Bestätigung durch Bereitstellung eines objektiven Nachweises, dass
die Anforderungen für einen spezifischen beabsichtigen Gebrauch oder
eine spezifische beabsichtigte Anwendung erfüllt worden ist.
(Normdefinition - DIN EN ISO 9000:2000) Erfolgreiche Prüfung dass etwas das tut was es soll.
(Umgangssprachlich)
Confirmation by examination and provision of objective evidence that
the particular requirements for a specific intended use can be
consistently fulfilled.
(21 Code of Federal Regulations § 820.3 z)
Bestätigung aufgrund einer Untersuchung und die Bereitstellung eines
Nachweises, dass festgelegte Vorgaben erfüllt worden sind.
(Normdefinition DIN EN ISO 9000:2000, DIN EN ISO 14971:2000) Bestätigung durch Bereitstellung eines objektiven Nachweises, dass
festgelegte Anforderungen erfüllt worden sind.
(Umgangssprachlich)
Confirmation by examination and provision of objective evidence that
specified requirements have been fulfilled.
(21 Code of Federal Regulations § 820.3 2 aa) UN-Spezialorganisation, Genf, 192 Mitgliedsstaaten, Gründung am
07.04.1948, Koordinationsbehörde der Vereinten Nationen für das
internationale öffentliche Gesundheitswesen.
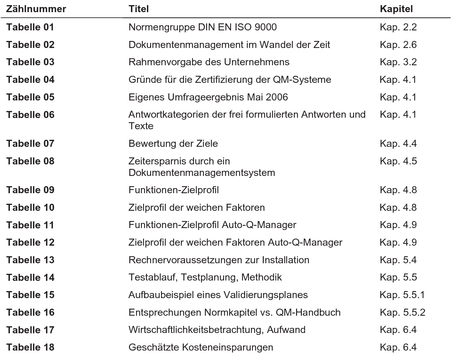
Tabellen- & Abbildungsverzeichnis IV
Tabellenverzeichnis
Einleitung
1.1 Problemstellung
da die Zertifizierung von Kunden und Lieferanten immer häufiger als Qualitätslabel nachgefragt wird. Ab einer bestimmten Größe des Unternehmens wird dies geradezu vorausgesetzt; sogar in kleineren und mittleren Unternehmen (KMU) wird immer häufiger an eine Zertifizierung gedacht. „Qualitätsmanagement (QM) ist eigentlich etwas Selbstverständliches. Die meisten erfolgreichen Unternehmen haben ein QM, oft, ohne es zu wissen oder es zu kennen. “ 1
eine Zertifizierung nach DIN EN ISO 9001:2000 ein Maßstab für die Auswahl Ihrer Lieferanten?“ antworteten 61% mit „Ja“.
möglichst nah an der optimalen Wertschöpfungskette bewegen, voraus. Der Dokumentationsnutzen wird in der DIN EN ISO 9000:2000 deutlich definiert: “Die Dokumentation ermöglicht die Vermittlung der Absichten und die Konsistenz von Maßnahmen. .., das Erstellen der Dokumentation sollte nicht Selbstzweck sein, sondern sollte eine Wertsteigernde Tätigkeit sein.“ 4 Daher sind funktionierende und Qualitätssichernde Prozesse 5 erforderlich, um den Kunden ein wirtschaftlich sinnvolles und qualitativ hochwertiges Produkt anzubieten, das zudem noch in Serie produziert werden kann und sich nicht als Einzelstück präsentiert.
Einleitung 2
Die Grundlage dessen können die fünf Partialanalytischen Qualitätsunterscheidungen von Garvin 6 sein:
Transcendent: (Absolute Qualität)
Versucht die höchstmögliche Vortrefflichkeit oder absolute Güte zu beschreiben.
Product Based: (Qualität des Produktes)
Technisch orientierter Ansatz mit quantifizierbaren und attributiv differenzierbaren Variablen.
User Based: (Qualität für den Kunden) Kundensubjektiv wahrgenommener Bewertungszusammenhang.
Manufactoring Based: (Qualität der Herstellung)
Herstellerorientierter Ansatz eines vorgegebenen internen Qualitätsstandards.
Value Based: (Qualität als Wert)
Wertorientierter Ansatz aufgrund einer Preis-Leistungs-Relation.
Strukturqualität, Prozessqualität und Ergebnisqualität zurück. Die Strukturdimension beinhaltet die technische und personelle Ausstattung eines Betriebes (exogene Faktoren) 9 . Zur Prozessdimension zählt die Art und Weise, wie Arbeitsabläufe erbracht werden (endogene Faktoren). Die Ergebnisqualität betrachtet die Resultate der erbrachten Leistung und ist damit die schwierigste Form der Qualitätssicherung.
des Rates der Europäischen Gemeinschaft und die Vorgaben speziell über eine aufzubauende und zu unterhaltende Dokumentation nach der Norm DIN EN ISO 13485 „Qualitätsmanagementsystem Medizinprodukte“ 12 für ein Unternehmen, das sich mit Medizinprodukten 13 beschäftigt hinzu, so ergibt sich ein umfassendes Aufgabengebiet im Bereich der Dokumentation, das ohne unterstützende Methoden und Mittel der Datenverarbeitung nicht mehr lösbar ist. Um die entstehende Masse der Dokumente bewältigen zu können, ist der Einsatz eines elektronischen
Einleitung 3
Dokumentenmanagementsystems daher unablässig. Der Nutzen des Dokumentenmanagements für ein Unternehmen zeigt sich in diesem Bereich u.a. in umfassender Vorgangsbearbeitung, Beschleunigung des Entscheidungsprozesses, Wertsteigerung durch aktuelle Information, Raumgewinn durch Platz sparende Speichermedien und höchste Sicherheit durch automatisches Backup.
Reparaturen oder fehlerhafte Produkte können reduziert werden oder fallen ganz weg. Hierdurch entsteht eine merkliche Kostenreduktion z.B. durch Senkung von Herstell- oder Reklamationskosten. Hinzu kommen strategische Vorteile gegenüber der Konkurrenz. Ein Zertifikat bedeutet Imagegewinn und die Möglichkeit, das Zertifikat als Marketing-Instrument einzusetzen. Durch nationale und internationale Anerkennung der ISO 9000 ff gilt das Unternehmen als ein Lieferant von qualitativ hochwertigen Produkten und Dienstleistungen. Auch bei der Einweisung neuer Mitarbeiter oder der Suche nach Lieferanten führt das unterstützende Qualitätsmanagementhandbuch (QMH) 14 zu einem schnellen Erfolg. Sofort erkennbar ist jedoch der vermeintliche Nachteil eines hohen Arbeitsaufwandes während der Einführung des komplexen QM-Systems. Der Dokumentationsaufwand der Arbeitsabläufe kostet sehr viel Zeit und führt zu Kritik über zuviel Bürokratie im Unternehmen. Diese Sichtweise ist jedoch eingeschränkt, da zwar für die neue Dokumentation am Anfang viel Aufwand betrieben werden muss, bei der späteren Pflege der Dokumente, insbesondere durch moderne Tools, sich dieser Aufwand jedoch schnell rechnet (Lebenszyklusmodell) 15 . Dies drückt sich außerdem in sinkenden Zugriffshäufigkeiten auf die Dokumente im Zeitverlauf aus. Der anfänglich hohe Aufwand wird dabei zu einem längeren positiven Nutzen für das gesamte Unternehmen.
Einleitung 4
Eine weitere Schwachstelle ist die starke Formalisierung der Arbeitsprozesse, die zu Demotivation und Konflikten unter den Mitarbeitern führen kann. Kreativität und Phantasie am Arbeitsplatz können durch die Standardisierung von Arbeitsabläufen unterdrückt oder zumindest stark eingeschränkt werden. Dieser Punkt wurde mit der neuen Norm DIN EN ISO 9000:2000 an veränderte Umgebungsbedingungen angepasst, u.a. wurde Mitarbeiterorientierung als ein wichtiger Punkt eingearbeitet.
die Produktion von Betonschwimmwesten zertifizieren.“
1.2 Fragestellung & Zielsetzung
(DMS) für die QM-Dokumentation, aufbauend auf dem Normenkreis DIN EN ISO 9000:2000, implementiert und validiert?
Weiterhin bringt ein effektives Dokumentenmanagementsystem, gerade im Anfangslebenszyklus eines Dokuments und den Phasen hoher Zugriffszahlen, für die Bearbeiter 18 und Nutzer eine erhebliche Aufwands- und Kostenreduktion durch:
Reduktion von:
monotoner, manueller, allgemeiner Tätigkeit (Formatierung, Versionisierung, Corporate Design).
Qualitätsteigerung von:
unsicherer Ablage, Versionisierungsinkonsistenz, langer Zugriffszeit, unkontrollierter Ablage.
Genüge zu tun, sondern vor allem auch in einer merklichen Straffung der Geschäftsprozesse des
Einleitung 5
Unternehmens, was sich in einer verbesserten Wettbewerbsfähigkeit bemerkbar macht. Der Schwerpunkt der Zielsetzung liegt dabei eindeutig auf einer Big Bang 20 Einführung in nahem Umfeld mit der Re-Zertifizierung nach dem prozessorientierten Normenkreis DIN EN ISO 9001:2000. Weiterhin sollen die in Kapitel 3.1 genannten Schwachstellen der bisherigen Praxis beseitigt werden. Aus diesem Grund wurden dessen Hauptpunkte in das Lastenheft und die Zielprofile zur Marktuntersuchung (vgl. Kapitel 4.8) aufgenommen.
erforderlichen Schulungen auszuarbeiten und durchzuführen, andererseits die Erstellung und Koordination der bereichsübergreifenden Inhalte des Dokumentenmanagementsystems.
umfassende Themenbehandlung nach der FDA Regulation 21 CFR Part 11 22 eingegangen. Dieser Themenbereich ist im Unternehmen bislang nicht erschöpfend umgesetzt, außerdem würde er den Umfang der Arbeit erheblich sprengen.
1.3 Aufbau, Struktur der Arbeit
Qualitätsmanagement-Dokumentation hin zu einer datenbankgestützten automatisierten Verwaltung anhand eines Web-basierten Dokumentenmanagementsystems. Um diesen Hauptteil sind ergänzende und für das Verständnis wichtige Aspekte gruppiert. Insbesondere die in den Normen zu findenden Hinweise auf „Dokumentation“ werden herangezogen. Im Einzelnen ist die vorliegende Arbeit folgendermaßen aufgebaut:
daher auch den dortigen Bestimmungen der Amerikanischen Gesundheitsbehörde Food and Drug Administration FDA 23 unterworfen ist. Daher muss die Betrachtung in diesen Wirtschaftsraum
Einleitung 6
ausgedehnt werden. Dargestellt wird dies im Hinblick auf die Zielzertifizierung (DIN EN ISO 9000:2000), da gleichzeitig mit dem Dokumentenmanagementsystem eine Re-Zertifizierung erfolgt. Schwerpunktmäßig werden dort einige Punkte des Dokumentenmanagements beleuchtet.
In Kapitel vier werden die Gründe der Zertifizierung, sowie deren Kosten dargestellt, es wird das Lösungskonzept aus den Grundlagenthemen erarbeitet, eine kurze betriebswirtschaftliche Betrachtung und der Rahmen des elektronischen Dokumentationsmanagementsystems werden definiert. Weiterhin sind Projektzeitplan, Marktuntersuchung, Lastenheft und Ergebnisbewertung Bestandteil dieses Kapitels. Mit dem in diesem Kapitel dargestellten Zielprofil wird das zu implementierende und validierende Dokumentenmanagementsystem ausgewählt.
aufgrund von aufgetretenen Softwarebugs notwendig wurden. Im theoretischen Teil dieses Kapitels werden Modelle der strukturierten Programmierung dargestellt, die eine Softwarevalidierung enthalten. Anhand eines praktischen Beispiels wird die Versionisierung eines Dokuments dargestellt. Ein Validierungsbeispiel findet sich ebenfalls in diesem Kapitel.
Validierungsprojektes.
Grundlagen & Rahmenbedingungen 7
2 Grundlagen & Rahmenbedingungen
Anforderungen. Nach den in diesem Kapitel dargestellten Grundlagen, vor allem normativer Natur, wurden die Zielvorgaben für das Dokumentenmanagementsystem entwickelt.
Dokumentation und Information (DIMDIV), die Vorgaben des Bundesinstitutes für Arzneimittel und Medizinprodukte (BfArM) und die Richtlinie 93/42/EWG des Rates der Europäischen Gemeinschaften systematisieren die Bereiche der Dokumente, die sich mit Medizinproduktezulassungen in Europa beschäftigen. Sie definieren einzelne Dokumente in der QM-Dokumentation und greifen auf die Grundlagen der Good Manufactoring Practice (GMP) zurück.
des Gesundheitswesens zählen. Kapitel 2.5 stellt eine Zusammenfassung dieser Grundlagen dar. Im Zuge der internationalen Harmonisierung (Mutual Recognition Agreement (MRA) 1998) 24 kann von einer generellen Übereinstimmung der FDA und GMP-Standards ausgegangen werden. 25
Grundlagen & Rahmenbedingungen 8
2.1 Qualitätsmanagementsystem
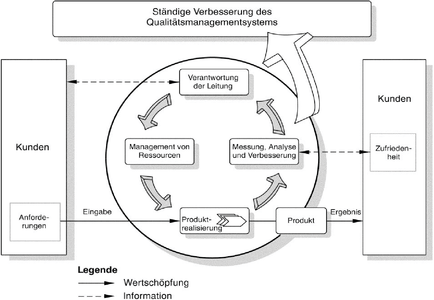
Abbildung 1: Ständige Verbesserung des Qualitätsmanagementsystems (Modell eines prozessorientierten
Qualitätsmanagementsystems) 27
Kundenanforderungen und angestrebter Kundenzufriedenheit dargestellt. Als wesentliches Ziel der Revision kann die Loslösung von überwiegend Produktionsunternehmen genannt werden. Weiterhin sind leichtere Handhabung und direktere Umsetzung der Norm in der Praxis durch Orientierung an den real ablaufenden Prozessen zu nennen.“
Grundlagen & Rahmenbedingungen 9
Hinzu kommt, dass Sprache und Vokabular durch eine natürlichere und präzisere Formulierung ersetzt wurden. Brauer stellt weitere Ziele fest: „Verbesserung der Kompatibilität mit anderen Managementsystemen, speziell mit Umweltmanagementsystemen, um so die Integrationsfähigkeit zu erhöhen, sowie das Ermöglichen und Unterstützen von Bewertungsverfahren zu Eigenbewertung.“
erwirtschaftenden Aufwandseinsparungen auf 10 % geschätzt.
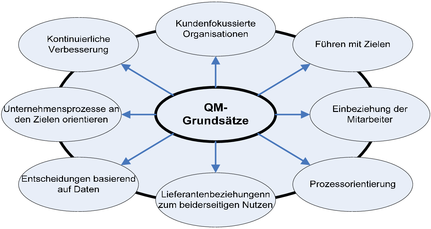
30 Abbildung 2: Qualitätsmanagement-Grundsätze
(Medizinproduktegesetz, MPG).
Grundlagen & Rahmenbedingungen 10
Die Förderung des Images durch die Qualifikation der Mitarbeiter mittels Fort- und Weiterbildung, aber auch die Risikoabsicherung durch Produkthaftung, ist von großer Bedeutung für das Unternehmen. Bruhn 31 stellt u.a. fest: „Insbesondere geht von der Aufgabe ‚Erlangung des Zertifikates’ eine positive Wirkung auf den Teamgeist innerhalb der zertifizierten Bereiche aus. Aufgrund der entstehenden Aufbruchstimmung können Kommunikationsprozesse über Qualitätsfragen intensiviert werden“.
2.2 Grundlegende Normen (Deutschland)
und 1994 kam die Neufassung - die DIN EN ISO 9000:1994 - auf den Markt.
das eigene Unternehmen passenden QM-Systems.
kontinuierlicher Verbesserungsprozess (KVP).
(Plan, Do, Check, Act) und stellt die kontinuierliche Anpassung des Fertigungsprozesses an aktuelle und verbesserte Gegebenheiten sicher (vgl. Abbildung 1). Daneben existiert nur noch eine Nachweisstufe - die ISO 9001. Sie enthält die Minimalforderung eines QM-Systems, auf der eine Zertifizierung ausschließlich erfolgt. Im Wesentlichen ist der Inhalt des Dokumentenmanagementsystems auf dieser Minimalforderung aufgebaut.
Grundlagen & Rahmenbedingungen 11
DIN EN ISO 9001:2000, 9004:2000
ISO 9001 und ISO 9004 bilden ein Paar und sind zur gemeinsamen Nutzung vorgesehen (sog. Konsistente Paare). 36 ISO 9004 stellt einen Leitfaden bereit, dessen Ziel die Leistungsverbesserung der Organisation sowie die Verbesserung der Kundenzufriedenheit ist. Ein wesentlicher Bestandteil sind dabei die von 20 Normelementen auf acht gekürzten Grundsätze der ISO 9001:2000. Aufgabe der Unternehmen ist es, diese acht Grundsätze in die Praxis umzusetzen, um ein modernes, funktionierendes und prozessorientiertes QM-System entlang der Wertschöpfungskette zu schaffen.
„Diese internationale Norm fördert die Wahl eines prozessorientierten Ansatzes für die Entwicklung, Verwirklichung und Verbesserung der Wirksamkeit eines Qualitätsmanagementsystems, um die Kundenzufriedenheit durch die Erfüllung der Kundenanforderungen zu erhöhen.“ 37
anstatt der späteren wesentlich teureren Behebung.“
Ein Managementsystem auf dieser Basis ist eine Ergänzung, kein Ersatz von Gesetzen oder behördlichen Erlassen. Es muss, unternehmensspezifisch umgesetzt, der Weiterbildung des gesamten Unternehmens dienen. Aufbau, Umsetzung und Zertifizierung erfolgen freiwillig oder aufgrund der Anforderungen von Kunden. Die Zertifizierung erfolgt daher auch durch privatwirtschaftliche Unternehmen und nicht durch staatliche Organisationen. Aus diesem Grund dient die ISO Normengruppe primär dem Systemanwender und verpflichtet ihn zu qualitativem und wirtschaftlichem Erfolg.
Grundlage aufbauende Norm DIN EN ISO 13485. Hierin wird speziell eine Dokumentationspflicht des QM-Systems verlangt, wobei die Inhalte der Dokumentation, der Veröffentlichung, der späteren Pflege, Änderung und Löschung dokumentiert sind.
ANMERKUNG: Um die Lesbarkeit zu vereinfachen, wird im Folgenden statt der exakten Langform „DIN EN ISO
9000:2000“ sofern möglich nur der Begriff „ISO 9000 ff“ verwendet
Grundlagen & Rahmenbedingungen 12
Die Normengruppe DIN EN ISO 9000 lässt sich zusammenfassend folgendermaßen gliedern:

Tabelle 1: Normengruppe DIN EN ISO 9000
Revision der Normengruppe EN 9000 (ISO 9001 und ISO 9004), die voraussichtlich im Jahr 2008 veröffentlicht werden soll. Im Herbst des Jahres 2006 soll eine Ausgabe der ISO 9000:2000 nicht als Amendment (Normativer Anhang) erscheinen, sondern als komplette Neuausgabe. Diese Neuausgabe soll die Ergebnisse des nach der Veröffentlichung der 2000er-Ausgabe durchgeführten Anpassungsprozesses enthalten.
2.3 Medizinproduktegesetz MPG (Deutschland)
Inverkehrbringen, das Inbetriebnehmen, das Ausstellen, das Errichten, das Betreiben und das Anwenden von Medizinprodukten sowie dessen Zubehör.
Es dient der Umsetzung u.a. der Richtlinie 93/42/EWG des Rates vom 14. Juni 1993 über Medizinprodukte und löst die Medizingeräteverordnung ab. 41 Es ist seit dem 14. Juni 1998 bindendes Recht. Zweck des Gesetzes ist es, den Verkehr mit Medizinprodukten zu regeln und dadurch für Sicherheit, Eignung und Leistung der Medizinprodukte sowie für Gesundheit und den erforderlichen Schutz der Patienten, Anwender und Dritter zu sorgen. Medizinprodukte, mit Ausnahme der In-vitro-Diagnostik 42 und der aktiven implantierbaren Medizinprodukte 43 , werden Klassen zugeordnet (vgl. Kapitel 2.4). Mit zwei Strafvorschriften
Grundlagen & Rahmenbedingungen 13
gehört das Medizinproduktegesetz zum Nebenstrafrecht 44 . Die aktuelle Fassung trägt das Datum 01.12.2003. 45
x Verantwortlichkeiten für das erstmalige Inverkehrbringen x Harmonisierte Normen, Technische Spezifikationen x Klassifizierungen, Abgrenzung zu anderen Produkten x Zusammenarbeit mit Benannten Stellen 47 und Prüflaboratorien x Klinische Bewertungen, Klinische Prüfungen x Risikenüberwachungsstrategien x Beobachtungs- und Meldesystem bei Vorkommnissen
Verordnung regelt die Erhebung der für das datenbankgestützte Informationssystem über Medizinprodukte benötigten Daten und ihre Übermittlung an das Deutsche Institut für medizinische Dokumentation und Information. 49 Aufgrund der in der DIMDI - Verordnung hervorgehobenen Dokumentationspflicht muss dies in der QM-Dokumentation enthalten und eindeutig festgelegt sein (Produktionsdokumentation, Rückverfolgbarkeit und Meldewesen). (Medizinproduktegesetz, MPG im Anhang)
2.4 Richtlinie 93/42/EWG, Harmonisierte Normung
(Europa)
in deutsches Recht umgesetzt und gilt für das Inverkehrbringen und die Inbetriebnahme von Medizinprodukten und ihrem Zubehör.
Grundlagen & Rahmenbedingungen 14
In dieser Richtlinie sind u.a. die Zulassungsbestimmungen für Medizinprodukte definiert, dazu gehört ein genehmigtes Qualitätssicherungssystem. Dieses enthält „nach Strategien und schriftlichen Verfahrensanweisungen geordnete Dokumente .. Handbücher .. Organisatorischer Aufbau .. Verfahren und Methoden .. einschlägige Unterlagen aus dem Verlauf der Herstellungsstufen …“ 50 Daher ist damit bereits der Minimalrahmen festgelegt, welche Themen in einer QM-Dokumentation unerlässlich sind.
risikoreichen Produkte beinhaltet, z.B. Nahtmaterial zur Anwendung am Herzen.
veröffentlicht. Hilfsmittel bzw. Norminhalte werden im Amtsblatt nicht inhaltlich abgelegt, können jedoch beim Beuth Verlag in Berlin erworben werden. (Richtlinie & Amtsblatt im Anhang)
2.5 FDA Regularien (USA)
verbindliche Vorschrift für Produkte und Dienstleistungen im amerikanischen Gesundheitsmarkt
Grundlagen & Rahmenbedingungen 15
aufbauend auf den Regeln zur guten Herstellungspraxis Good Manufacturing Practice, GMP 54 . Diese Quality System Regulation (QSR) 21 CFR unterteilt sich in einzelne Subparts, Subpart A, 820.1 General Provisions, Scope bis Subpart O. 820.250 Statistical Techniques. 55 Für die Softwarevalidierung werden die Subpart 21 CFR § 820.30 (g) Design Control, § 820.40 Production and Processcontrols, § 820.70 Process Controls, § 820.75 Process Validation, § 820.100 Corrective and preventive Action herangezogen. Weiterhin verweist die „Final Guidance for Industry and FDA Staff“ auf die Section 201(h) des Federal Food, Drug, and Cosmetic Act (the Act). 56 Ziele der FDA sind zur Sicherung des hohen Qualitätsstandards für US Bürger:
x Verbesserung der Produktesicherheit
x Einsatz und Förderung modernster Technologie (Innovation, Entwicklung) x Verbesserung der Produktionsprozesse x Schnelle und sichere Informationspolitik x Bequemere Arbeitsplätze
der in vielen Fällen zwar regional angepasst, aber dennoch nahezu ohne Einschränkungen übernommen wurde. Die FDA hat z.B. einen Code of Federal Regulation (CFR) herausgegeben, der den Gebrauch von „Electronic Records“ und „Electronic Signatures“ regelt (21 CFR Part 11), diese Vorschrift ist weltweit das wichtigste Dokument in diesem Bereich. 57
Vorgaben der US-amerikanischen Behörden manifestierten sich in den 1978 verabschiedeten Current Good Manufactoring Practice (CGMP) 58 - Richtlinien. Der entsprechende EG-GMP 59 - Leitfaden ist im Rahmen der europäischen Harmonisierung in deutsches Gesetz umgewandelt
Grundlagen & Rahmenbedingungen 16
worden, ebenso ist der GMP-Leitfaden der World Health Organization, WHO 60 analog den Vorgaben der USA und Europa erstellt. Beispielsweise ist im GMP relevanten Umfeld (z.B. Arzneimittelherstellung) nach Definition der EG-GMP Richtlinien Annex 11 und dem deutschen Arzneimittelgesetz eine Systemvalidierung gefordert. 61 Für den Bereich der Produktdokumentation gibt es von der FDA dort sehr genaue Vorschriften. Dies ist jedoch nicht Bestandteil dieser Arbeit.
auch eine Auslegung der gemeinsamen Bestimmungen der europäischen und amerikanischen Gesundheitsbehörden. 63
Charakter und keinen Gesetzescharakter. Zertifizierungen nach ISO 9000 ff sind kein Ersatz für Validierungen. Die in dieser Arbeit dargestellte Validierung basiert u.a. auf den Vorgaben, welche die FDA Regelwerke aufstellen (vgl. Kap. 4.9).
Grundlage von EN ISO 9001:2000 erarbeitet wurde. Das primäre Ziel dieser internationalen Norm ist die Ermöglichung der Harmonisierung der für Medizinprodukte zutreffenden gesetzlichen Anforderungen an Qualitätsmanagementsysteme. Mit dieser Norm wird ein Qualitätsmanagementsystem für Medizinprodukte speziell für regulatorische Zwecke festgelegt. 64
speziell in den allgemeinen Anforderungen der Norm geregelt. Für die Dokumentation des Entwicklungs- und Fertigungsprozesses (Produktentstehung und Produktrealisierung) ist explizit kein elektronisches Dokumentenmanagement gefordert, jedoch wird es aufgrund von Rahmenvorgaben für die Dokumentation und lückenlose Historie, was wirtschaftlich heute kaum anderweitig realisierbar ist, unverzichtbar. „Es muss geplante Validierungen zur Design- und Entwicklungsvalidierung geben“ (vgl. Kapitel 7.3.6 der Norm). „Analog dazu müssen
Grundlagen & Rahmenbedingungen 17
dokumentierte Verfahren für die Validierung der Anwendung der Computersoftware festliegen, die bei Tätigkeiten in der Produktion und Dienstleistung eingesetzt werden. Es müssen Aufzeichnungen der Validierung geführt werden.“ (vgl. Kapitel 7.5.2.1 der Norm)
detaillierter und von erweitertem Umfang.
2.6 Dokumentenmanagementsysteme
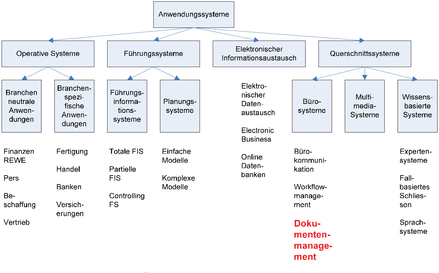
Abbildung 3: Anwendungssysteme 66
Grundlagen & Rahmenbedingungen 18
Inhalte des Dokumentenmanagements
Inhalte bzw. Typen des Dokumentenmanagementes (DMS) können aus dem gesamten Umfeld des Unternehmens kommen und unterschiedlichster Natur sein. Beispiele hierfür:
x Daten aus der MS-OFFICE - Umgebung des Unternehmens (WORD, EXCEL, OUTLOOK) x Daten aus VISIO (Visualisierungssoftware) (Diagramme, Organigramme) x Bilddaten, Präsentationen (POWERPOINT, Video) x Daten aus Intranet, Internet (HTML, XML)
x Daten aus individuellen Applikationen des Unternehmens (ERP, ACCESS, CAD 67 , Audio)
Merkmale von Dokumenten können sein:
x Physische Eigenschaften (Papier, Datei) x Formale Eigenschaften (Aufbau, Gestaltung, Corporate Design 69 ) x Ordnungshierarchie (Fachliche Hierarchie, Versionisierung) x Inhaltliche Hierarchie (Bezug, Zugehörigkeit) x Charaktereigenschaften (Information, Dokument, Urkunde, Record) x Zeit (Entstehungszeitpunkt, Geltungsdauer) x Herkunft (Ersteller, Prüfer, Freigeber, Abteilung) x Nutzer (Empfänger, Berechtigungen)
Fotos, Zeichnungen und Belege. Im hiesigen Rechtsraum wurden bisher überwiegend Papierdokumente mit rechtsgültiger Unterschrift als rechtlich relevant angesehen. Durch das am 16.05.2001 verkündete Signaturgesetz 70 beziehungsweise den 21 CFR Part 11 (Electronic Records & Electronic Signature) der FDA wird sich zukünftig eine Änderung abzeichnen. Die Umsetzung dieser Vorschriften in regionales Recht kann nach vorherrschender Meinung nicht als trivial bezeichnet werden. 71 (Signaturgesetz & 21 CFR Part 11 im Anhang)
Grundlagen & Rahmenbedingungen 19
Zur besseren Unterscheidung gegenüber einer Verwaltung von Papierdokumenten = Schriftgutverwaltung, wird häufig auch der Begriff „EDM“ (Electronic Document Management) verwendet. Umfang und Funktionalität klassischer Dokumentenmanagementsysteme sind annähernd in der ISO-Norm ISO / IEC 10166 DFR (Document Filling & Retrieval) definiert - leider erlangte diese Norm nie große Bedeutung und ist auch nicht Bestandteil dieser Arbeit.
verwendete Arten können z.B. kaufmännische oder technische Dokumente sein.
- Arbeit zitieren
- Dipl. Kfm (FH) Harald Steffen (Autor:in), 2006, Einführung und Validierung einer datenbankgestützten Qualitätsmanagementdokumentation in einem mittelständischen Unternehmen der Medizintechnik, München, GRIN Verlag, https://www.grin.com/document/186240
Kostenlos Autor werden






















Kommentare